編輯點評:用來學好化學的必備應用
非常適合學習化學的中學生和高中生,化學方程式app可以用來模擬做試驗,更快更方便的學習化學方程式內容,還支持在線修改方程式及最全的元素周期表,想要復習化學的家長同學必備。

功能介紹
【五大模塊】
“化學方程式”軟件包含方程式、俗稱、顏色、性質與周期表五大模塊。每一模塊緊密結合、相輔相成,可以很好的幫助同學們更全面學習與認知。
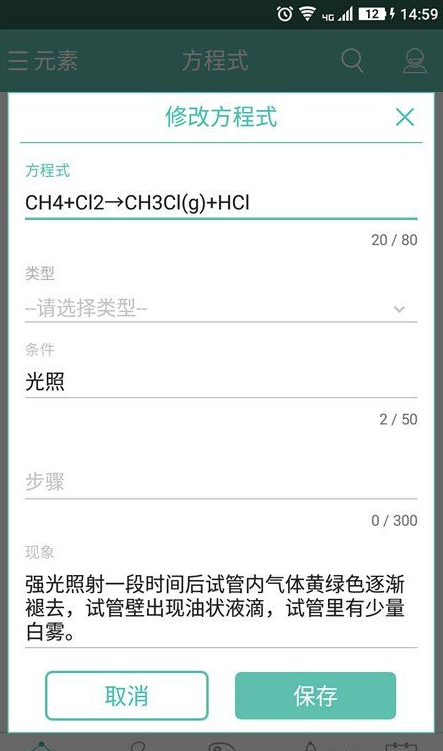
【軟件宗旨】
本軟件一直致力于“為同學們提供最便捷、最齊全的化學查詢工具”為宗旨,經過三年發展,數據也日趨完善,目前已經滿足了初高中大部分同學的需求。本軟件獨特的搜索技術以及顯示技術,可以幫助你迅速的找到你要查找的知識點,方便而快捷。
作者的話
化學是一門很神奇的學科,我們生活中的方方面面都離不開化學,化學的魅力之處在于她能夠解釋清楚我們所處環境中的各種現象與本質。本軟件著眼點在課本,卻高于課本。軟件的精益求精也是我們一直奮斗的目標。希望本軟件能夠一直伴隨同學們的學生生涯,給同學們帶來學習上的便利。我與你們一起,共同探索、共同進步!
高中必背化學方程式
高一化學必修一化學方程式大全
1、鈉在空氣中燃燒(黃色的火焰)
2Na + O2==【點燃】Na2O2
鈉塊在空氣中變暗
4Na+O2=2Na2O
Na2O在空氣中加熱(變黃)
2Na2O+O2=2Na2O2
2、鈉與水反應(浮、熔、游、響、紅)
2Na + 2H2O = 2NaOH + H2 ↑
2Na + 2H2O = 2Na+ + 2OH- + H2↑
3、過氧化鈉與水的反應(放熱反應、Na2O2是強氧化劑,用于漂白)
2Na2O2 + 2H2O = 4NaOH + O2 ↑
2Na2O2 + 2H2O = 4Na+ +4OH -+O2↑
堿性氧化物Na2O與水的反應
Na2O+H2O=2NaOH
4、過氧化鈉可用在呼吸面具和潛水艇中作為氧氣來源,原因是:
2Na2O2 + 2CO2 = 2Na2CO3 + O2
5、蘇打(純堿)與鹽酸反應
①鹽酸中滴加純堿溶液
Na2CO3 + 2HCl = 2NaCl + H2O+CO2↑
CO32- + 2H+ = H2O + CO2↑
②純堿溶液中滴加鹽酸,至過量
Na2CO3 + HCl =NaHCO3 + NaCl
CO32- + H+ = HCO3-
NaHCO3+HCl=NaCl+H2O+CO2↑
HCO3-+H+ = H2O +CO2↑
6、小蘇打受熱分解
2NaHCO3==【加熱】Na2CO3 + H2O +CO2 ↑
7、固體氫氧化鈉和碳酸氫鈉混合物在密閉容器中加熱
NaHCO3 + NaOH==【加熱】Na2CO3 + H2O
HCO3-+ OH - = H2O + CO32-
(若是溶液中反應有離子方程式)
8、金屬鋰在空氣中燃燒
4Li + O2==【加熱】2Li2O
9、氯氣的性質
銅絲在氯氣中劇烈燃燒(棕色煙)
Cu + Cl2==【點燃】CuCl2
之后加水,可由綠色溶液(濃)得到藍色溶液(稀)
Cl2 +2FeCl2 =2FeCl3
2Cl2+2NaBr=2NaCl+Br2
Cl2 +2NaI =2NaCl+I2
Cl2+SO2 +2H2O=H2SO4 +2HCl
2Na + Cl2 ==【點燃】2NaCl
10、鐵在氯氣中劇烈燃燒 2Fe +3Cl2==【點燃】3FeCl3
11、氫氣在氯氣中燃燒(蒼白色火焰)
H2 + Cl2==【點燃】2HCl
氟氣與氫氣反應(黑暗處即可爆炸)
H2+F2=2HF
12、氯氣溶于水(新制氯水中含H+ 、Cl-、ClO-、OH-、Cl2、HClO、H2O)
Cl2 + H2O = HCl + HClO
Cl2 + H2O = H+ + Cl- + HClO
13、次氯酸見光分解(強氧化劑、殺菌消毒,漂白劑)
2HClO==【光照】2HCl + O2↑
14、工業制漂白粉的原理及漂白粉的失效
2Ca(OH)2 + 2Cl2 =Ca(ClO)2 + CaCl2 +2H2O
2Ca(OH)2 +2Cl2 =2Ca2++2ClO-+2Cl-+2H2O
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
2HClO==【光照】 2HCl + O2↑
Ca2-+2ClO-+ CO2 + H2O =CaCO3↓+ 2HClO
15、氯氣的實驗室制法:(儀器:分液漏斗,圓底燒瓶)
MnO2 +4HCl(濃)==【加熱】 MnCl2+Cl2↑+2H2O
MnO2 +4H++2Cl-==【加熱】Mn2++Cl2↑+2H2O
16、新制氯水注入盛溴化鈉溶液的試管中
Cl2 + 2NaBr = Br2 + 2NaCl
Cl2 + 2Br- = Br2 + 2Cl-
17、鐵與硫加熱反應 Fe + S==【加熱】FeS
鐵與氧氣加熱反應 3Fe+2O2==【加熱】Fe3O4
鐵在氯氣中加熱反應 2Fe+3Cl2==【加熱】2FeCl3
18、銅與濃硫酸反應: Cu+2H2SO4 (濃) ==【加熱】CuSO4 +2H2O+SO2 ↑
19、碳與濃硫酸反應: C+2H2SO4(濃)==【加熱】2H2O+CO2↑+2SO2↑
20、工業制單質硅(碳在高溫下還原二氧化硅)
SiO2 + 2C=(高溫)Si + 2CO↑
21、二氧化硅與氫氧化鈉反應
SiO2 + 2NaOH = Na2SiO3 + H2O
SiO2 + 2OH+ = SiO32- + H2O
22、氮氣和氫氣反應(工業合成氨)
N2 + 3H2→【催化劑】 2NH3
2NH3→【高溫高壓】N2 + 3H2
23、氮氣和氧氣放電下反應(雷雨發莊稼)
N2 + O2=(放電)2NO
2NO + O2=2NO2
二氧化氮溶于水
3NO2 + H2O =2HNO3 + NO
3NO2 + H2O =2H++ 2NO3-+NO
24、HNO3與Fe的反應
Al、Fe遇濃HNO3、濃硫酸鈍化(常溫)
Fe與濃HNO3加熱
Fe+6HNO3==【加熱】 Fe(NO3)3+3NO2↑+3H2O
Fe與稀HNO3反應
Fe+4HNO3=Fe(NO3)3+NO↑+2H2O
3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O
25、NO2 、O2 的混合氣通入水中無剩余氣體
4NO2 + O2 + 2H2O = 4 HNO3
26、NO 、O2 的混合氣通入水中無剩余氣體
4NO + 3O2 + 2H2O = 4 HNO3
27. 氨的催化氧化
4NH3 +5O2 ==【催化劑、加熱】4NO + 6H2O
28. 碳酸氫銨受熱分解
NH4HCO3==【加熱】 NH3 ↑+ H2O↑ + CO2↑
29. 用濃鹽酸檢驗氨氣(白煙生成)
HCl + NH3 = NH4Cl
30. 硫酸銨溶液與氫氧化鈉溶液混合加
(NH4)2SO4 +2NaOH==【加熱】2NH3↑+Na2SO2 +2H2O
NH4+ + OH-==【加熱】NH3 ↑+ H2O
31. 硝酸銨溶液與氫氧化鈉溶液混合(不加熱)
NH4NO3 + NaOH = NH3·H2O + NaNO3
NH4+ + OH- = NH3·H2O
32. 鋁箔在氧氣中劇烈燃燒
4Al + 3O2 ==2Al2O3
33. 鋁片與稀鹽酸反應
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al + 6H+ = 2Al3+ +3H2↑
34. 鋁與氫氧化鈉溶液反應
2Al+2NaOH +2H2O = 2NaAlO2 +3H2↑
2Al + 2OH- +2H2O = 2AlO2- + 3H2↑
35. 鋁與三氧化二鐵高溫下反應(鋁熱反應)
2Al + Fe2O3==【高溫】 2Fe + Al2O3
36. 鎂在二氧化碳中燃燒
2Mg + CO2 ==【點燃】2MgO + C
37. 氧化鋁溶于氫氧化鈉溶液
Al2O3 + 2NaOH = 2NaAlO2 +H2O
Al2O3 + 2OH- = 2AlO2- + H2O
38. 硫酸鋁溶液中滴過量氨水
Al2(SO4)3 +6NH3·H2O=2Al(OH)3↓+(NH4)2SO4
Al3+ + 3 NH3·H2O = Al(OH)3↓+ 3NH4+
39. ①氫氧化鋁溶液中加鹽酸
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
②Al(OH)3與NaOH溶液反應
Al(OH)3 + NaOH = NaAlO2 +2 H2O
Al(OH)3 + OH- = AlO2- +2 H2O
40. 高溫下鐵與水反應
3Fe + 4H2O(g)==【高溫】 Fe3O4 + 4H2
41. 鐵與鹽酸反應
Fe + 2HCl = FeCl2 + H2↑
Fe + 2H+ = Fe2+ + H2↑
42. 氧化鐵溶于鹽酸中
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe2O3 + 6H+ = 2Fe3+ + 3H2O
43. 氯化鐵中滴入氫氧化鈉溶液(紅褐色沉淀)
FeCl3 + 3NaOH = Fe(OH)3 ↓+3NaCl
Fe3+ + 3OH- = Fe(OH)3 ↓
44. 氫氧化亞鐵在空氣中被氧化(白色沉淀變為紅褐色沉淀)
4Fe (OH)2 + O2 + 2H2O = 4Fe (OH)3
45. 氯化亞鐵溶液中通入氯氣
2FeCl2 + Cl2 = 2FeCl3
2 Fe2+ + Cl2 = 2 Fe3+ + 2Cl-
46. 氯化鐵溶液中加入鐵粉
2FeCl3 + Fe =3FeCl2
2Fe3++ Fe = 3Fe2+
47. 用KSCN檢驗Fe3+的存在離子方程式
Fe3++3SCN-= Fe(SCN)3
元素周期表規律
一、金屬活動性順序表:
金屬活動性順序由強至弱: K Ca na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
(按順序背誦) 鉀 鈣 鈉 鎂 鋁 鋅 鐵 錫 鉛 (氫) 銅 汞 銀 鉑 金
金屬活動性順序規律:
1.金屬位置越靠前的活動性越強,越易失去電子變為離子,反應速率越快。
2.排在氫前面的金屬能置換酸里的氫,排在氫后的金屬不能置換酸里的氫,跟酸不反應。
3.排在前面的金屬,能把排在后面的金屬從它們的鹽溶液里置換出來。排在后面的金屬跟排在前面的金屬的鹽溶液不反應。
4.混合鹽溶液與一種金屬發生置換反應的順序是“先遠”“后近”。
注意:*單質鐵在置換反應中總是變為+2價的亞鐵。
例:判斷金屬活動性強弱
例3 、 有X、Y、Z三種金屬,將三種金屬分別放入稀硫酸中,Y溶解并放出氫氣,X 、Z不溶解,將X浸入Z的硫酸鹽溶液中,在X的表面有Z析出。則三種金屬的活動性由強到弱的順序是( )
A.Y、Z、X
B.Y、X、Z
C.X、Y、Z
D.Z、X、Y
解析:三種金屬分別浸入稀硫酸中,Y溶解放出H2,X、Z不溶解,可推判在金屬活動性順序表中,Y排在H的前面,X、Z排在H的后面;將X浸入的Z硫酸鹽溶液中,X能置換出Z,可判斷X的活動性比Z的強,故選B。
二、元素周期表的規律
1.1 原子半徑
(1)除第1周期外,其他周期元素(惰性氣體元素除外)的原子半徑隨原子序數的遞增而減小;
(2)同一族的元素從上到下,隨電子層數增多,原子半徑增大。
1.2 元素化合價
(1)除第1周期外,同周期從左到右,元素最高正價由堿金屬+1遞增到+7,非金屬元素負價由碳族-4遞增到-1(氟無正價,氧無+6價,除外);
(2)同一主族的元素的最高正價、負價均相同
1.3 單質的熔點
(1)同一周期元素隨原子序數的遞增,元素組成的金屬單質的熔點遞增,非金屬單質的熔點遞減;
(2)同一族元素從上到下,元素組成的金屬單質的熔點遞減,非金屬單質的熔點遞增
1.4 元素的金屬性與非金屬性
(1)同一周期的元素從左到右金屬性遞減,非金屬性遞增;
(2)同一主族元素從上到下金屬性遞增,非金屬性遞減。
1.5 最高價氧化物和水化物的酸堿性
元素的金屬性越強,其最高價氧化物的水化物的堿性越強;元素的非金屬性越強,最高價氧化物的水化物的酸性越強。
1.6 非金屬氣態氫化物
元素非金屬性越強,氣態氫化物越穩定。同周期非金屬元素的非金屬性越強,其氣態氫化物水溶液一般酸性越強;同主族非金屬元素的非金屬性越強,其氣態氫化物水溶液的酸性越弱。
1.7 單質的氧化性、還原性
一般元素的金屬性越強,其單質的還原性越強,其氧化物的氧離子氧化性越弱;元素的非金屬性越強,其單質的氧化性越強,其簡單陰離子的還原性越弱。
例:元素周期表規律的考察
如圖為元素周期表的一部分.下列說法不正確的是( )
A.鈉、鎂、鋁三種原子的電子層都有3個層
B.氫、鋰、鈉三種原子的最外層都有1個電子
C.鈹、鎂兩種原子易得到電子變成離子
D.圖中有5種金屬元素
試題解析:
A.鈉、鎂、鋁三種原子位于第3周期,故核外都是三個電子層上有電子;故正確;
B.氫、鋰、鈉三種原子位于第一主族,最外層都有1個電子;
C.鈹、鎂兩種原子的最外層有2個電子,故是易失去電子達到穩定結構;
D.根據元素名稱可知圖中鋰、鈹、鈉、鎂、鋁5種金屬元素.
答案:C.
上邊我們通過了試題及其詳細的講解給我們同學講解了金屬活動性順序表和元素周期表的規律,希望同學們下邊多做相應試題,牢記這些規律,爭取中考在次不失分。
更新日志
版本1.1.0.33
1、優化夜間模式
2、優化網絡請求
3、優化資源加載
更新說明1.1.0.22
1、增加附錄數據
2、優化權限授權
3、優化資源加載
1.1.0.17更新
1、優化打印功能
2、優化頁面顯示
3、優化提交功能

 快手極速版2024最新版
快手極速版2024最新版 快手2024最新版官方正版
快手2024最新版官方正版 百度地圖app手機最新版
百度地圖app手機最新版 墨跡天氣app官方版
墨跡天氣app官方版 美團官方手機客戶端
美團官方手機客戶端 釘釘手機版app
釘釘手機版app 中國農業銀行app
中國農業銀行app 光速虛擬機安卓正版
光速虛擬機安卓正版 美團外賣app官方版
美團外賣app官方版 中國移動官方營業廳
中國移動官方營業廳





















 國網學堂app官方正版1.0.1 安卓手機版
國網學堂app官方正版1.0.1 安卓手機版 賽課堂app官方版v1.1.1.4 安卓最新版
賽課堂app官方版v1.1.1.4 安卓最新版 i外貿app官方版v2.0.9 手機最新版
i外貿app官方版v2.0.9 手機最新版 e會學安徽智慧教育云平臺3.3.8 官方版
e會學安徽智慧教育云平臺3.3.8 官方版 曉黑板APP安卓版1.0.1 官方版
曉黑板APP安卓版1.0.1 官方版 全民K詩手機最新版2.6.14 官方版
全民K詩手機最新版2.6.14 官方版 三字經全文朗讀完整版1.2.7 手機版
三字經全文朗讀完整版1.2.7 手機版 訊飛智教學平臺v1.3.1 安卓最新版
訊飛智教學平臺v1.3.1 安卓最新版 語法分析助手官方版2.7.0 安卓版
語法分析助手官方版2.7.0 安卓版 默寫助手手機版1.5.16 安卓版
默寫助手手機版1.5.16 安卓版 網易有道慧學手機版2.8.1 官方版
網易有道慧學手機版2.8.1 官方版 中級經濟師安卓版5.1 手機版
中級經濟師安卓版5.1 手機版 西安小科輔教app安卓版v1.3.8 官方最新版
西安小科輔教app安卓版v1.3.8 官方最新版 安培空間app最新版本v8.4 安卓手機版
安培空間app最新版本v8.4 安卓手機版 琴魂樂譜安卓版v2.0 最新版
琴魂樂譜安卓版v2.0 最新版 三晉會計網app官方正版v1.0.18 安卓手機版
三晉會計網app官方正版v1.0.18 安卓手機版 斑馬駕考寶典app2.2.0 安卓最新版
斑馬駕考寶典app2.2.0 安卓最新版 反向詞典手機版v2.0.5 最新版
反向詞典手機版v2.0.5 最新版 CEC血管論壇appv1.2.0 最新版
CEC血管論壇appv1.2.0 最新版 sketchbook官方正版app6.0.7 手機版
sketchbook官方正版app6.0.7 手機版 崇州公交車培訓平臺v0.0.3 最新版
崇州公交車培訓平臺v0.0.3 最新版 大小: 30.0M
大小: 30.0M
















 手機翻唱軟件
手機翻唱軟件 云手機免費版
云手機免費版 找暑假工的軟件推薦
找暑假工的軟件推薦 農村信用社軟件合集
農村信用社軟件合集 MT管理器下載
MT管理器下載 雨課堂手機app
雨課堂手機app
 學習強國app手機版
學習強國app手機版
 中國科大官方版
中國科大官方版
 寫作高手最新版下載
寫作高手最新版下載
 猿編程HD官方正版
猿編程HD官方正版
 Notion ai寫作軟件app官方正版
Notion ai寫作軟件app官方正版
 建筑云課學生端app官方版
建筑云課學生端app官方版
 3d建模繪畫學習(Easy Pose)
3d建模繪畫學習(Easy Pose)
 易加互動平臺app下載手機版
易加互動平臺app下載手機版
 卡酷少兒app官方版
卡酷少兒app官方版
熱門評論
最新評論